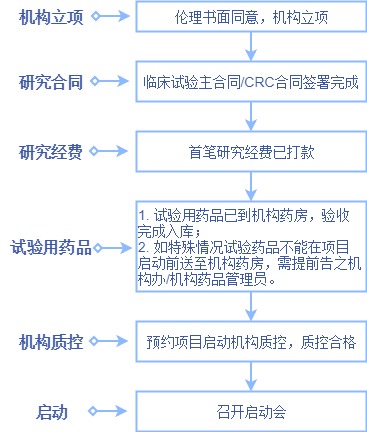
启动会前必须准备完成的材料:
1. 完成授权表,PI和被授权人签字完成(机构模板见附件Form-019-3.0,可使用申办方自己的授权表);
2. 被授权人的简历、GCP证书、执业证书等;
3. 培训试题(纸质或二维码在线,见附件3)、签到表(附件Form-018-3.0)、培训PPT等;
4. 其他申办方需要自己准备的材料,如中心启动访视报告、启动会随访信,如有请提前发至机构邮箱;
5. 机构需对项目启动前进行质控,请参照附件Form-009-3.0临床试验启动质控表的检查项目,进行准备,准备好后,自行约机构质控员进行质控,质控结果为同意启动方可启动。
6. 项目启动会议统一在机构会议室(门诊一楼),需至少提前2-3天告之机构启动会召开时间。
启动会结束后保存材料至研究者文件夹:
1. PI签字完成的授权表复印件;
2. 启动会签到表、会议纪要、ppt复印件、参加启动会人员填写的培训试题或在线答题后台数据的纸质版;
3. CRA监查员的项目启动监查确认函、监查结果报告(如有);
4. 其它机构需要的材料,机构联系邮箱aysfylcsyjg@163.com。
 皖公网安备 34019002600206号
皖公网安备 34019002600206号